
Encéphalopathie hépatique
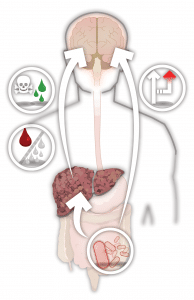
L’encéphalopathie, terme faisant référence au dysfonctionnement cérébral, est attribuable à de nombreuses causes. L’encéphalopathie hépatique (EH) se produit lorsque le foie cesse de fonctionner adéquatement ou lorsque le sang provenant des intestins contourne le foie dans un phénomène que l’on appelle shunt porto-systémique. L’EH peut se manifester sous forme de toute une gamme d’anomalies neurologiques et psychiatriques.
Le foie a plusieurs fonctions; entre autres, il désintoxique le sang, il produit la bile, il emmagasine l’énergie et il métabolise une variété de composés. L’ammoniac est produit dans le tractus gastro-intestinal par la dégradation bactérienne des nutriments ainsi que par le processus métabolique normal des cellules intestinales. Normalement, le foie décompose l’ammoniac en urée qui est excrétée dans l’urine. Quoique la façon dont l’EH se développe soit complexe et mal comprise, un facteur important est la perte de la capacité du foie à désintoxiquer l’ammoniac, qui circule alors dans le sang et atteint le cerveau. Les médecins croient qu’un excès d’ammoniac et d’autres toxines jouent un rôle central dans les symptômes débilitants de l’encéphalopathie, ceux-ci pouvant aller de subtils changements de personnalité à la confusion et même au coma.
Causes
Il existe trois principaux types d’encéphalopathie hépatique, lesquels sont définis par le problème sous-jacent.
Le type A résulte d’une insuffisance hépatique aiguë, qui se produit lorsqu’un patient connaît une détérioration rapide de la fonction hépatique. Cette détérioration peut être causée par de nombreux facteurs, y compris sans s’y limiter, les médicaments, une infection virale ou une maladie auto-immune.
Le type B se produit dans le cadre d’un shunt porto-systémique. Dans cet état, le système circulatoire contourne le foie, habituellement à cause d’une anomalie congénitale ou par suite d’une chirurgie.
Le type C est le résultat d’une cirrhose. Les personnes aux prises avec une maladie chronique du foie découlant d’une hépatite virale (telle que l’hépatite B ou C), d’une stéatose hépatique non alcoolique, de la consommation d’alcool, de l’hépatite auto-immune ou d’une autre cause pourraient être à risque de développer une cirrhose. La cirrhose fait référence à l’aspect précis et au degré de tissu cicatriciel présent dans le foie, indiquant une maladie avancée. Cette condition se développe graduellement, le tissu cicatriciel remplaçant lentement le tissu en santé au fil du temps.
Souvent, un facteur déclencheur joue un rôle dans un épisode d’EH, notamment une infection, un saignement gastro-intestinal, une surdose d’un diurétique, des troubles électrolytiques, la déshydratation et la constipation.
Symptômes/Complications
 Les médecins utilisent habituellement les critères de West-Haven pour déterminer le degré de gravité de l’EH.
Les médecins utilisent habituellement les critères de West-Haven pour déterminer le degré de gravité de l’EH.
EH latente (Signes et symptômes subtils; il peut être nécessaire d’avoir recours à des tests spéciaux pour son diagnostic)
- Minimale : Diagnostic posé au moyen de tests psychométriques ou neuropsychologiques en absence de manifestations cliniques évidentes.
- Stade 1 : Signes et symptômes subtils tels que léger manque de sensibilisation, tendance à oublier, perturbations du sommeil, difficulté à se concentrer et légers changements de personnalité comme l’irritabilité, la dépression, l’anxiété et l’euphorie.
EH déclarée (Signes et symptômes apparents sur le plan clinique, allant de modérés à sévères)
- Stade 2 : Léthargie, apathie, confusion, problèmes de mémoire graves et un comportement inhabituel ou inapproprié.
- Stade 3 : Confusion et désorientation prononcées (le patient pourrait ne pas comprendre qui il est ou pourrait oublier où il est), somnolence et comportement étrange.
- Stade 4 : Coma sans réaction aux stimuli de douleur.
Un signe important décelé pendant l’examen physique est l’astérixis, un tremblement des mains généralement suscité lorsque les bras et les poignets sont tendus. Ce signe est normalement indicateur d’une encéphalopathie de stade 2 ou plus avancée.
Puisque l’EH se manifeste le plus souvent comme une complication résultant d’une insuffisance hépatique, il pourrait y avoir la présence d’autres symptômes, reflétant la gravité sous-jacente de la maladie du foie, notamment une décoloration jaune de la peau (jaunisse) ou du blanc des yeux (ictère scléral) et une accumulation de fluide dans l’abdomen (ascite).
Épidémiologie
La prévalence de l’EH latente dans les populations atteintes de cirrhose pourrait être très élevée, mais étant donné que les signes et symptômes sont subtils et que des tests spéciaux peuvent être requis pour son diagnostic, la prévalence réelle est probablement sous-estimée dans un environnement clinique typique. Au cours des cinq années suivant le diagnostic d’une cirrhose, le risque de connaître un premier épisode d’EH déclarée (EHD) est de 5 à 25 %. Après l’occurrence d’un premier épisode, il y a 40 % de probabilité de vivre un événement récurrent dans l’année qui suit. Chez les personnes qui souffrent d’accès récurrents d’EHD, le risque de connaître un autre événement récurrent dans les six mois qui suivent est de 40 %.
Diagnostic
Le diagnostic de l’encéphalopathie hépatique se fait sur le plan clinique, le fournisseur de soins de santé s’appuyant sur les antécédents médicaux, un examen physique et possiblement des tests de laboratoire ou des essais cognitifs spéciaux. L’identification et le recours à des soins médicaux de façon précoce constituent une première étape très importante. La contribution de membres de la famille ou d’amis proches est souvent utile pour cerner des changements subtils pouvant mener au diagnostic et aussi pouvant aider à évaluer la réponse aux stratégies de gestion.
Des tests additionnels sont souvent effectués pour explorer davantage les éléments pouvant être des facteurs déclencheurs. Les niveaux d’ammoniac dans le sang sont habituellement élevés chez les personnes atteintes de cirrhose, même en absence d’EH, ce qui veut dire que des niveaux élevés d’ammoniac sont rarement un élément utile dans la détermination d’un diagnostic. Cependant, de faibles taux d’ammoniac dans le sang d’une personne chez qui l’on soupçonne l’EH pourrait inciter le clinicien à considérer un autre diagnostic.
Gestion
Modifications à l’alimentation et au mode de vie
Bien qu’autrefois l’on considérait comme approprié un régime pauvre en protéines dans la gestion de l’EH, il n’est plus recommandé aujourd’hui. Une évaluation détaillée de l’état nutritionnel et l’élaboration de recommandations précises selon les circonstances individuelles est souvent justifiée et devrait faire l’objet d’une discussion avec son fournisseur de soins de santé.
Éviter toute forme d’alcool, si cela n’a pas encore été fait, est d’une importance capitale. Tous les médicaments, y compris sans s’y limiter, les produits en vente libre qui pourraient avoir un effet sédatif, devraient être examinés par le fournisseur de soins de santé.
Une personne ayant reçu un diagnostic d’EH, ou chez qui on soupçonne l’EH, ne devrait pas conduire un véhicule ou opérer de la machinerie lourde.
Médicaments
Le lactulose, un sucre non absorbable (disaccharide), demeure le traitement efficace le plus courant dans le traitement de l’EHD. Pris sous forme liquide, ses effets bénéfiques proviennent du fait qu’il baisse le pH dans le tractus gastro-intestinal et modifie la flore intestinale. En raison de son effet laxatif, les patients devront ajuster la quantité prise de façon à produire deux à trois selles molles par jour. Ses effets secondaires peuvent comprendre la nausée, les ballonnements, le malaise abdominal, la diarrhée et la déshydratation.
La rifaximine (Zaxine®) est un antibiotique administré par voie orale qui est peu absorbé et qui exerce donc principalement son effet sur les bactéries trouvées dans le tractus gastro-intestinal, zone qui est ciblée. Elle est utilisée comme thérapie additive en combinaison avec le lactulose quand des épisodes récurrents d’EHD continuent de se produire avec un traitement uniquement au lactulose. La rifaximine étant habituellement bien tolérée, elle peut aussi être une solution de remplacement appropriée pour les personnes qui sont intolérantes au lactulose en raison de ses effets secondaires.
Bien que le lactulose et la rifaximine sont de loin les agents les plus couramment utilisés et les plus étudiés dans le traitement de l’EHD, d’autres médicaments ont été étudiés, y compris les acides aminés à chaîne ramifiée (BCAA), la L-ornithine L-aspartate (LOLA), les probiotiques et d’autres antibiotiques.
Après le diagnostic d’un premier épisode d’EHD et de son traitement adéquat, une thérapie continue comme décrite ci-dessus est normalement indiquée pour prévenir une récurrence.
Chirurgie
Puisque la cause de l’EH est typiquement chronique ou découle d’une insuffisance hépatique aiguë, lorsqu’elle ne répond pas à la thérapie médicale ou que des épisodes récurrents se produisent en dépit d’un traitement médicamenteux maximal, il peut être approprié de procéder à une évaluation pour déterminer la nécessité d’une greffe du foie.
L’avenir
L’encéphalopathie hépatique est une affection sérieuse qui peut être une cause récurrente d’invalidité grave. Ses symptômes varient de légers troubles du sommeil à la confusion, la désorientation et même le coma. Un diagnostic précoce de l’EH est essentiel puisqu’il permet une identification et une gestion plus rapides de tout facteur déclencheur. Si vous ou un être cher êtes atteint de cirrhose et que vous éprouvez des symptômes d’encéphalopathie hépatique, nous vous encourageons d’en parler avec votre médecin dès que possible.
